Vi leser ofte at metan er en mye kraftigere drivhusgass enn CO2 – en faktor 20-30 sterkere oppgis ofte.
Forskning.no gir en forklaring: «Metan er en kraftigere klimagass enn CO2. Det skyldes bindingene i molekylene. Enkeltbindingene i metan, eller CH4, kan fange opp mer av den infrarøde varmestrålingen enn dobbeltbindingene i CO2-molekylet.»
Dette der ut til å være hentet fra Dag O. Hessens eminente bok «C. Karbon – en uautorisert biografi» (2017). På side 82 leser man: «Kort fortalt bidrar enkeltbindingene i CH4 til å fange opp mer av den infrarøde varmestrålingen fra jorda enn dobbeltbindingen i CO2.»
Hessen skriver videre: «På molekylbasis, CH4 mot CO2, er CH4 40 ganger mer effektiv som drivhusgass. Siden atomvekten av CH4 bare er 16, mens den er 44 for CO2 endres regnestykket med en faktor 2,75 i metanets favør om vi gjør om til vekt (altså 120 ganger mer effektivt). Men så var det dette med utholdenheten. Mange klimamodeller, samt det internasjonale klimapanelet IPCC, beregner forskjell i oppvarmingspotensial over 100 år, og da kommer 1 kilo CH4 ut som 20-30 ganger så potent som en kilo CO2 fordi CH4 brytes mye raskere ned i atmosfæren«.
Meldingen er altså krystall-klar: Det skyldes forskjeller på de to molekylene.
Samtidig er ikke forklaringen en forklaring: For HVORFOR spiller enkeltbindinger versus dobbelbindinger så avgjørende rolle?
Gassers termiske egenskaper har mye med vibrasjoner å gjøre, og det er jo klart at da spiller stivheten til bindingene en rolle. Og en dobbeltbinding er vel stivere enn en enkeltbinding! Men, massen er også viktig for frekvensen, og CH4’s hydrogenatomer er 16 ganger så lette som CO2’s oksygenatomer.
Og ganske riktig: Man finner at den relevante vibrasjonsfrekvensen for CO2 er mindre enn den for CH4!
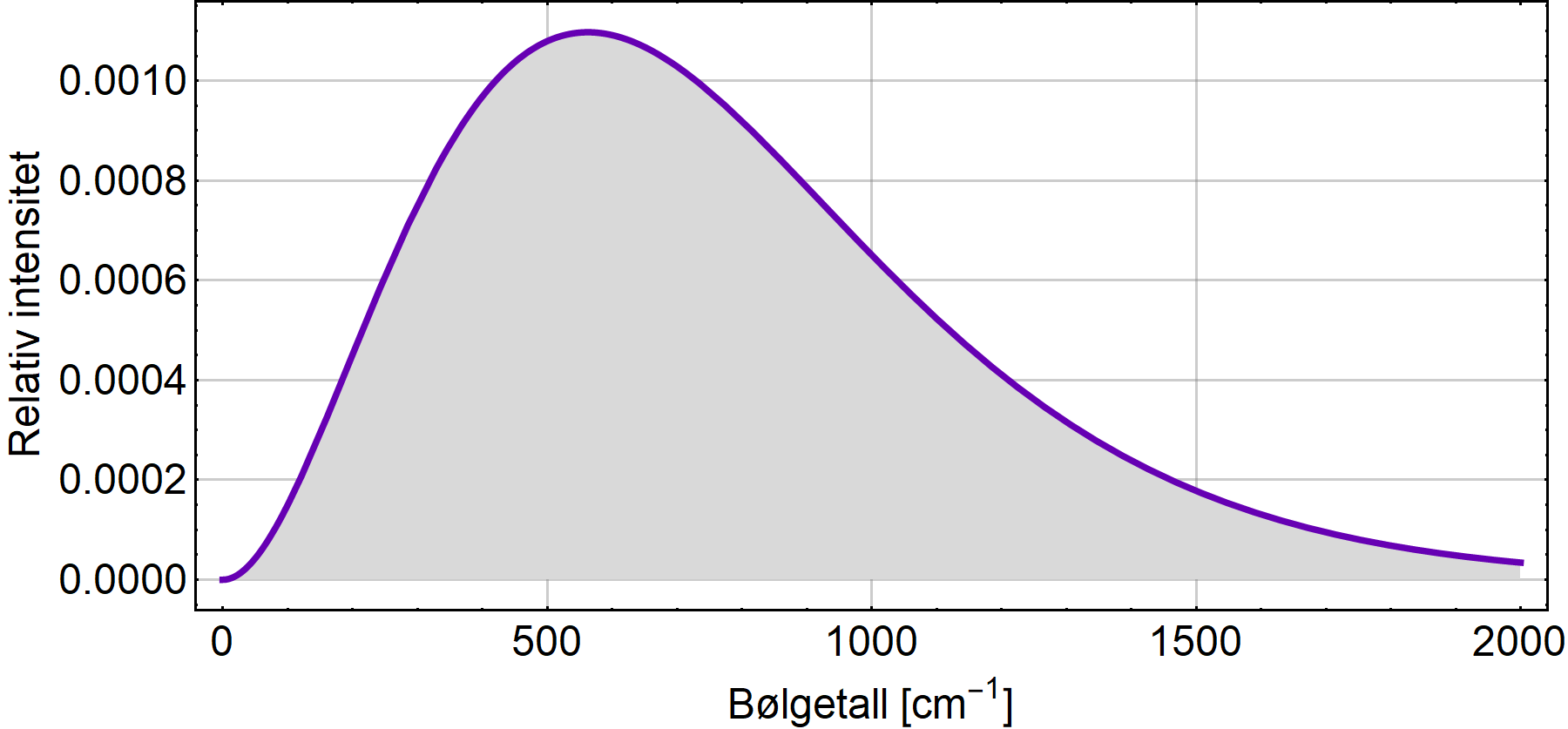
I tillegg kommer at frekvensen for CO2 treffer nesten midt på toppen av intensiteten for naturlig varmestråling, mens metan ligger ute på flanken.
Begge har en viss overlapp med vanndamp, og det er forskjeller i energien for rotasjon (den er størst for metan pga de lette H-atomene) som har betydning for linjebredde, men det er vanskelig å se at forskjeller i det skal gi så stort utslag. Det er faktisk nærliggende å tenke at molekyl for molekyl kunne CO2 være noe mer effektivt en CH4 – pga plasseringen nesten midt på toppen.
Figurene under viser varmestrålingsspekteret ved 14 grader og de relevante linjene for CO2 (midten) og CH4 og vanndamp (nederst).
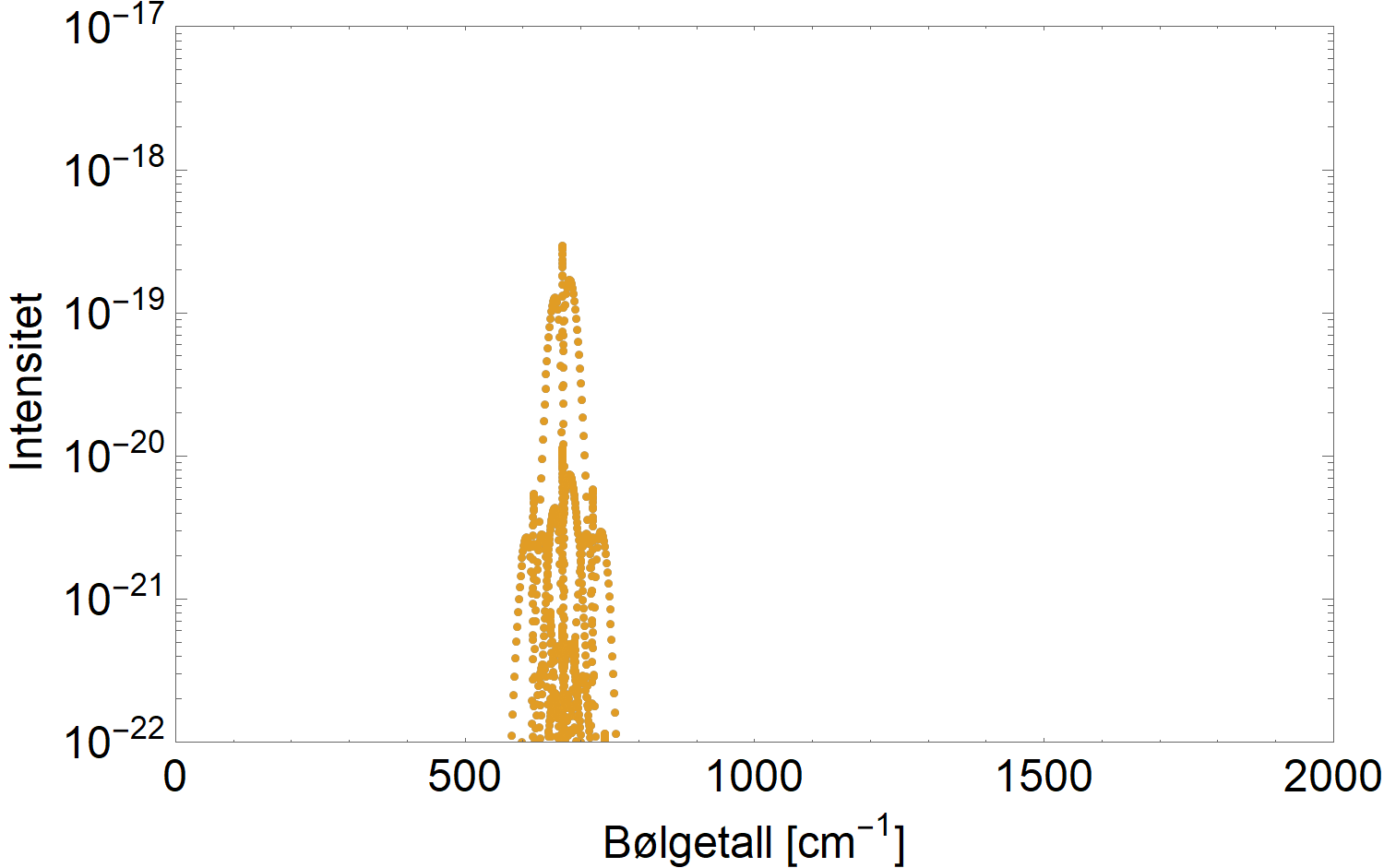
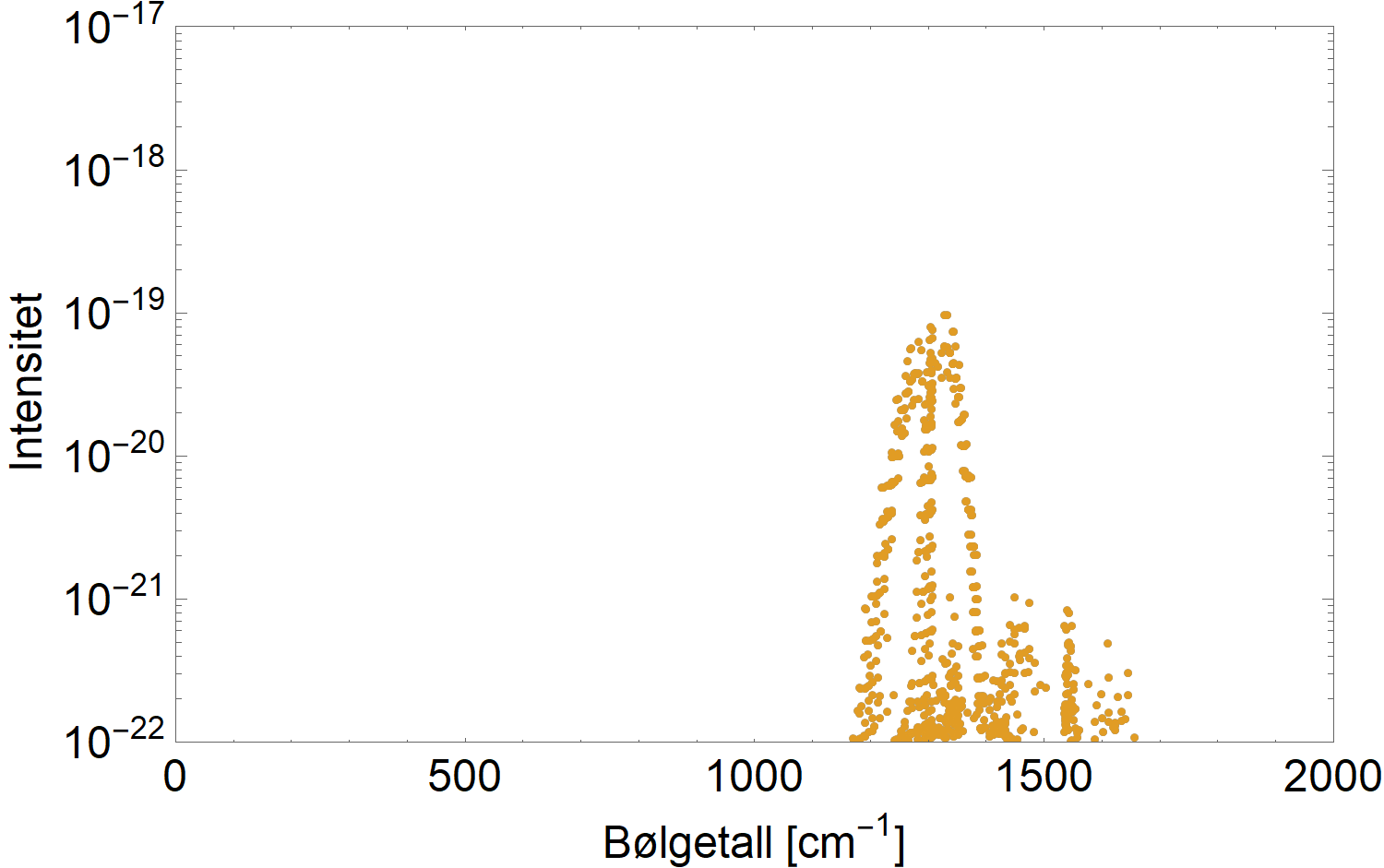
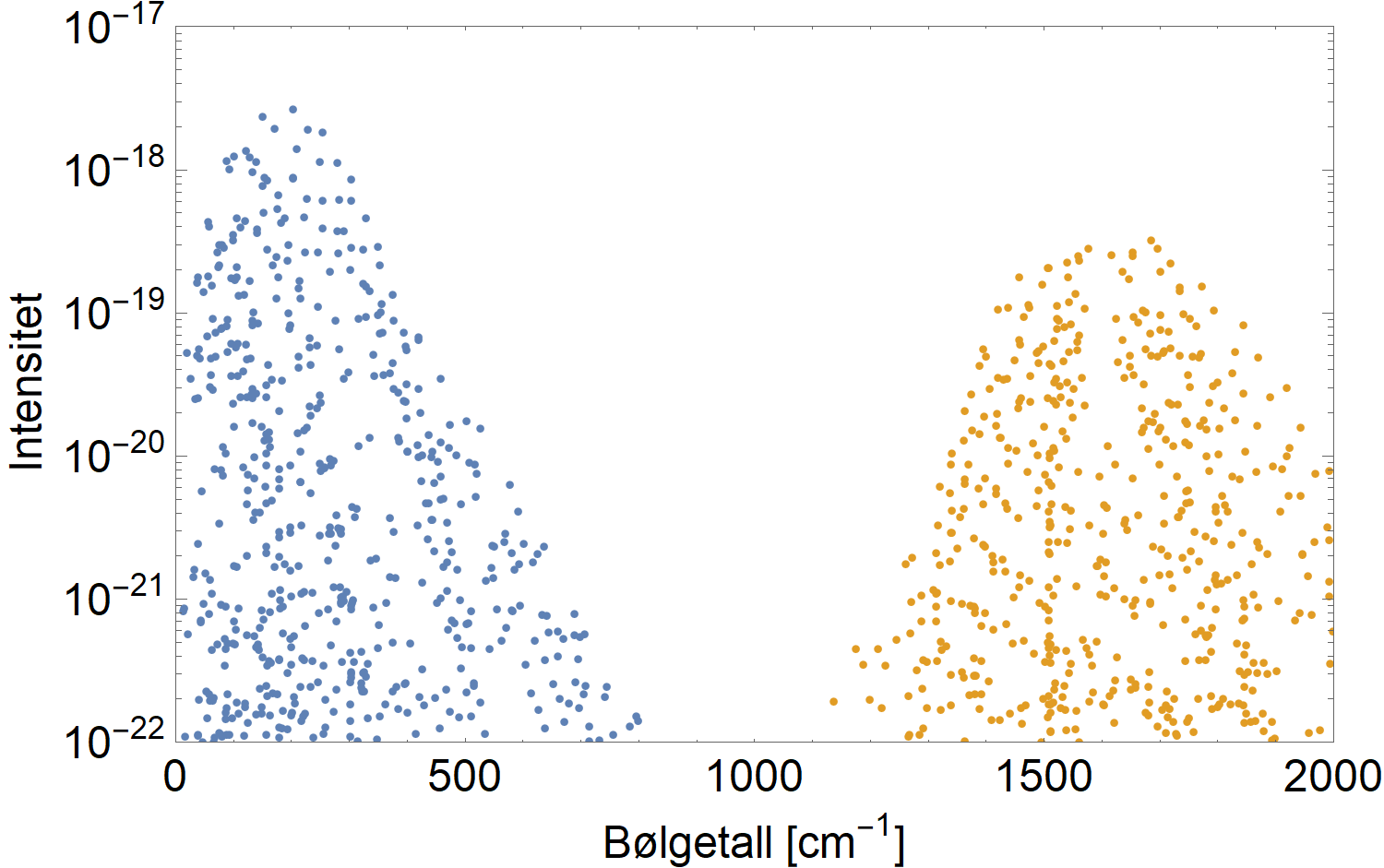
Men Hessen sier altså en faktor 120 i metanets favør. Man kan bli forvirret av mindre.
Heldigvis er ikke oppklaringen langt unna. I 1998 publiserte de to norske forskerne Gunnar Myhre og Frode Stordal sammen med engelske kolleger artikkelen «New Estimates for radiative forcing due to well mixed greenhouse gases».
Den viser at «radiative forcing» er sterkt ikke-lineær med mengden – den faller av når mengden øker. Deres Tabell 3 viser at med nåtidens CO2 på noen hundre ppm og nåtidens CH4 på rundt 2 ppm modelleres CO2 logaritmisk og CH4 som kvadratrot. Altså: Jo flere molekyler som er sluppet ut, jo mindre er virkningen av neste.
Eller tenk deg du har en spenningskilde som leverer 1 volt. Kopler man inn en motstand på 1 ohm, får man en strøm på 1 ampere. Med to motstander i serie blir strømmen 1/2 ampere, med tre 1/3 ampere osv. Forskjellen mellom motstand 100 og 101 er minimal – selv om alle er helt like.
Konklusjonen blir altså: Hovedgrunnen til at CH4 framstår som en kraftigere klimagass, er at det er å mye mindre av den i atmosfæren. Det er IKKE primært en egenskap ved selve molekylene.
Hvor «sterk» en drivhusgass er avhenger av molekylets egenskaper, hvor mye det er av det, hvordan overlapp med andre molekyler er, og hvilken tidshorisont man ser på.
Se også
— Arne Marius Raaen —
